Medicina
La guerra contro la sla appesa al filo dei costi della ricerca
Le malattie neurodegenerative, come la malattia di Alzheimer, il morbo di Parkinson, la Corea di Huntington, la Sclerosi Multipla e la Sclerosi Laterale Amiotrofica, sono patologie caratterizzate dalla perdita lenta e progressiva di una o più funzioni del sistema nervoso. Si tratta di forme gravemente invalidanti, finora trattate con scarsi risultati attraverso la somministrazione di farmaci puramente sintomatici. È una di quelle cose che, quando ti capitano, sono una condanna definitiva. Almeno fino ad oggi: in Giappone, di questi tempi, c’è una fiammella di speranza…
Il numero di persone affette da neuro-degenerazione è drammaticamente elevato. L’Alzheimer colpisce circa 50 milioni di persone nel mondo[1] e questo numero è destinato, in assenza di trattamenti realmente efficaci, ad aumentare drasticamente a causa dell’innalzamento dell’età media e, quindi, dell’aumento della quota di popolazione a rischio. Secondo le stime dell’Organizzazione Mondiale della Sanità ci sono 10 milioni di malati di Parkinson[2] e, come accade per l’Alzheimer, passati i 65 anni di età l’incidenza aumenta sensibilmente. La Sclerosi multipla colpisce oltre 2,8 milioni di persone[3], mentre la SLA conta almeno tra i 200 mila e i 300 mila malati con un forte incremento annuo[4].
L’impatto è devastante: malattie come l’Alzheimer sono progressive, hanno una durata media di 10 anni durante i quali l’autonomia del paziente non smette di diminuire, richiedendo impegno e costi crescenti. Oltretutto, questi malati non sono quasi mai ospedalizzati e oltre il 75% delle cure e dell’assistenza è fornita dalle famiglie, che vivono un dramma quotidiano finora irrisolvibile. Ma la scienza lotta con tutte le sue forze per cambiare questa situazione e, soprattutto nel campo chiamato motoneuronale, ottiene finalmente dei successi. Specie da quando si è iniziato a lavorare sulla flessibilità di un farmaco che abbiamo da quasi mezzo secolo, l’Ibudilast, e che si sta rivelando pieno di piacevoli sorprese.
Il sistema nervoso ed i suoi neuroni
Il corpo umano è attraversato da una complessa struttura, il sistema nervoso, che scambia le informazioni necessarie ad attivare i singoli organi del nostro corpo, molti dei quali funzionano, grazie al sistema nervoso, in modo involontario. Il sistema è diviso in due sottosistemi: il sistema nervoso centrale (SNC)[5], che interessa cervello, cervelletto, midollo spinale e tronco encefalico, ed il sistema nervoso periferico (SNP)[6], che controlla il resto e si divide in sistema autonomo e sistema somatico. Quest’ultimo, quello volontario o somatico, governa le attività che svolgiamo consapevolmente, come usare una matita, calciare un pallone, parlare e così via. Il primo, quello autonomo, detto anche involontario o vegetativo, regola i processi automatici come il battito cardiaco, la respirazione, i processi metabolici e così via.
Il primo sottosistema (SNC) è formato dai neuroni e dalle fibre nervose che si trovano nel cervello, protetto dalla scatola cranica, e nel midollo spinale, contenuto all’interno della colonna vertebrale. Il sistema nervoso centrale è quel laboratorio che raccoglie ed elabora i segnali che provengono dal sistema periferico e da cui partono i comandi verso il sistema periferico stesso[7]. Il sistema nervoso periferico (SNP), invece, è costituito dai recettori e dai nervi che, dalla periferia, inviano informazioni verso midollo e cervello. Al contrario del sistema nervoso centrale, che è protetto dalla scatola cranica e dal canale spinale, lo SNP non gode di alcuna protezione[8].
Eccitabilità significa che la cellula nervosa reagisce a degli stimoli esterni (fisici e chimici) che vengono convertiti in impulso nervoso. Ad esempio un neurone nell’orecchio interno viene eccitato da un’onda sonora, quello della pelle viene eccitato dal caldo o dal freddo, quello dell’occhio dalla luce, quello olfattivo da un odore, oppure quello del muscolo dalla percezione di uno sforzo o di una resistenza[11]. Conducibilità significa che l’impulso nervoso, generato da una cellula nervosa a causa della sua eccitabilità, può essere trasmesso alle altre cellule sotto forma di impulso elettrico in corrispondenza delle giunzioni cellulari, chiamate sinapsi[12].
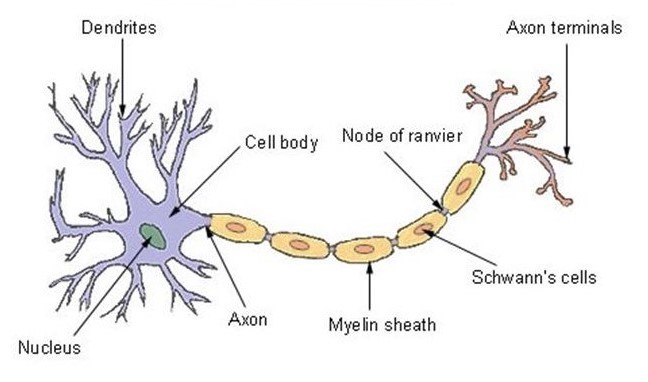
Il neurone ha una delle strutture più note in natura e, per questo motivo, il suo disegno è stato copiato dallo scrittore Arthur C. Clarke e dal regista Stanley Kubrick per creare l’astronave Discovery One per il film “2001 Odissea nello Spazio”[13]. Il nucleo, situato sulla parte anteriore, viene chiamato soma, e contiene gli enzimi che rendono il neurone attivo[14]. Le parti centrali, chiamate dendriti e di forma tubolare, sono le ramificazioni che – come antenne – ricevono e decodificano i segnali provenienti dal sistema nervoso[15].
La terza regione, l’assone, è un’appendice che può anche superare il metro di lunghezza – come nel caso dei neuroni che controllano la muscolatura volontaria – oppure essere lunga solo pochi micron[16]. Deputato alla trasmissione dei segnali dal centro verso la periferia, l’assone ha spesso ramificazioni collaterali che permettono all’assone di distribuire l’informazione in diverse destinazioni nel medesimo istante[17].
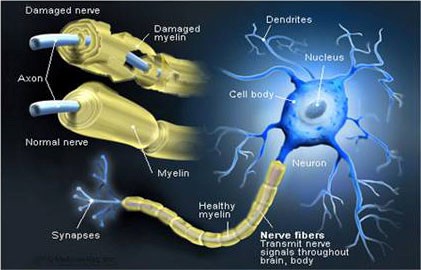
La fibra nervosa è quindi costituita dall’assone – che è la struttura fondamentale che consente la conduzione dell’impulso – e da una guaina che lo riveste e che contribuisce ad isolare ed a proteggere le fibre nervose, oltre che ad aumentare la velocità di trasmissione dell’impulso. Questa guaina si chiama mielina, e non si trova ovunque: nel cervello e nel midollo spinale i neuroni fanno a meno di questa protezione[20]. La mielina è una sostanza isolante a struttura lamellare, costituita da molecole di grassi e di proteine, che riveste esternamente gli assoni dei neuroni[21] e la cui struttura, quasi 200 anni fa, ha ispirato l’invenzione della pila elettrica[22].
Le funzioni della mielina sono diverse: a) consente la corretta trasmissione degli impulsi nervosi, amplificandone (se necessario) la velocità; b) protegge e nutre l’assone che sta avvolgendo[23]. La mielinizzazione difettosa di un nervo è la causa principale di diverse malattie neurologiche: accade infatti che ci sia una lesione o persino una perdita di guaina mielinica che circonda i nervi – o a causa di un’infezione, oppure per motivi metabolici o genetici: qualunque sia la causa, la perdita di mielina porta alla disfunzione nervosa e al rallentamento od addirittura al blocco della trasmissione dei messaggi tra i neuroni interessati e quindi dei comandi del cervello alle singole parti del corpo[24].
Una delle malattie più gravi e più conosciute, causate dalla demielinizzazione, è la sclerosi multipla, a causa della quale le lesioni demielinizzanti del sistema nervoso centrale si verificano nel cervello, causando diversi sintomi tra cui dolore, disfunzione cognitiva e motoria, ed infine disturbi visivi[25].
I motoneuroni e la sclerosi laterale amiotrofica
Come un’astronave, il corpo è una macchina estremamente complessa, guidata da un tipo particolare, detti motoneuroni, perché controllano i milioni di spostamenti di assoluta precisione che ci permettono di controllare le nostre azioni anche nelle azioni più complesse e che hanno bisogno della coordinazione di tantissime funzioni. Per questo esistono i neuroni sensitivi o afferenti, che trasportano l’informazione dagli organi sensoriali al sistema nervoso centrale; ed i neuroni intercalari, che si fanno carico dei dati forniti dai neuroni sensoriali e li trasmettono ai neuroni motori. Questi ultimi, i neuroni motori (o motoneuroni), sono specializzati nel diffondere impulsi di tipo motorio e coordinato ad ogni singolo organo della periferia corporea[26] – un compito che è assolutamente miracoloso.
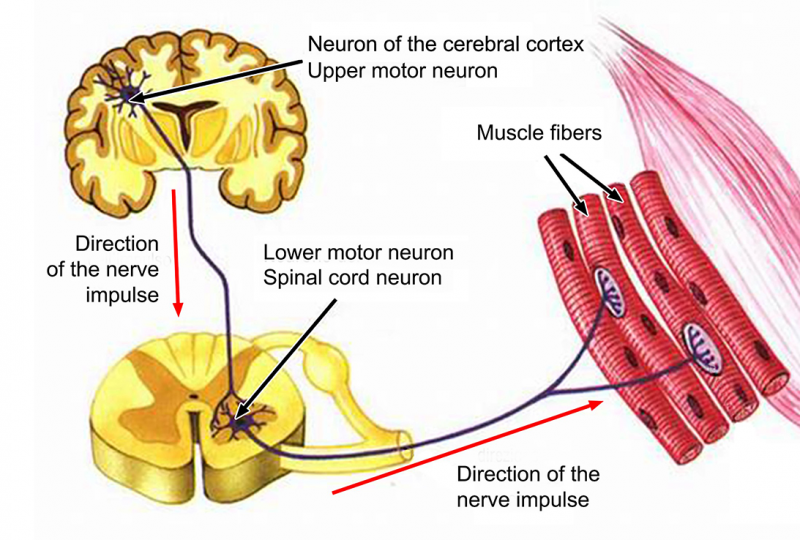
Il motoneurone è tra le cellule di maggior volume nel sistema nervoso e se ne distinguono due tipi: Il primo motoneurone – detto anche centrale – è la cellula localizzata nella corteccia frontale motoria che invia un lunghissimo prolungamento verso il basso, fino all’apice del midollo spinale a raggiungere, appunto, il secondo motoneurone. Il secondo motoneurone – detto anche periferico – è quella cellula che dall’interno del midollo spinale esce, raggiunge la periferia e va ad innervare il muscolo scheletrico[27]. Una struttura che, alla fine degli anni 70, è stata usata da Carlo Rambaldi per creare il mostro della trilogia cinematografica “Alien”[28].
La Sclerosi Laterale Amiotrofica (SLA), conosciuta anche come malattia di Lou Gehrig, dal nome del campione del baseball cui è stata diagnosticata la prima volta[29], è una malattia neurodegenerativa progressiva dell’età adulta, ed appartiene ad un gruppo di patologie che hanno in comune la progressiva degenerazione di un tipo specifico dei motoneuroni[30]. Nel caso in cui la degenerazione colpisce il primo motoneurone abbiamo la sclerosi laterale primaria[31], nel caso in cui l’infezione colpisce il motoneurone periferico, abbiamo in presenza dell’atrofia muscolare progressiva[32] – quella che, per intenderci, ha colpito il notissimo astrofisico Stephen Hawking[33].
La sclerosi laterale amiotrofica (SLA) è invece una patologia che vede una progressiva degenerazione contemporanea di entrambi i tipi di motoneuroni, sia i primi che i secondi, fino alla morte del paziente[34]. Le fibre nervose smettono di inviare i messaggi ai muscoli e col tempo, questi ultimi si indeboliscono e vanno incontro prima a contrazioni, chiamate fascicolazioni[35], e poi al deperimento, ovvero l’atrofia[36]. Alla fine il sistema neuronale perde completamente la capacità di avviare o controllare i movimenti volontari.
Le cause che generano la SLA sono purtroppo in larga parte sconosciute, ma ciò che è certo è che a determinarle sono una serie di concause. Si fa sempre più strada la convinzione che alla base ci sia una mutazione genetica, ma un altro fattore decisivo pare che sia quello ambientale, o tossico-ambientale: numerose indagini portano a pensare che l’inquinamento causato da alcuni metalli o pesticidi possano provocare lo sviluppo della malattia[37].
Gli scienziati lavorano sulla fenomenologia – come l’accumulo di proteine anomale all’interno della cellula o l’incapacità della cellula di provvedere autonomamente all’eliminazione di queste proteine malate[38]. Oppure lo stato infiammatorio delle cellule gliali, che sono cellule concorrono al nutrimento dei neuroni[39]. A volte si verifica un difetto nel meccanismo di trasporto intraneuronale dei segnali[40] o c’è un eccesso di glutammato[41].
Magari si scoprono delle carenze dei fattori di crescita dei nervi[42] o delle sinapsi, o persino dei mitocondri, che sono le cellule del DNA che portano in sé il messaggio genetico che stabilisce se siamo animali o piante, rettili o mammiferi, uomini o donne[43]. Tutto questo porta gli scienziati alla disperazione: stiamo ancora cercando di capire cosa accada e come, ma non abbiamo ancora nessuna idea sul perché, eppure bisogna fare qualcosa, e quindi si cerca qualche sostanza che, senza guarire la degenerazione, la rallenti o la possa fermare.
Le fasi della sperimentazione dei farmaci
Fase 1 – Viene avviata la somministrazione su un numero limitato di volontari sani, il cui obiettivo principale è verificare l’eventuale insorgere di effetti collaterali, si osserva come il farmaco agisce nel corpo umano e come il corpo lo gestisce[47]. Nei casi in cui si osservino reazioni gravi, oppure si capisca che l’efficacia è legata all’uso di dosi troppo massicce, il nuovo farmaco viene abbandonato. La corsa finisce lì.
Fase 2 – si indaga sulla reale potenzialità terapeutica del farmaco. Stavolta il farmaco viene somministrato a soggetti volontari affetti dalla patologia per cui la molecola è stata pensata. Questa fase dura un paio d’anni, durante i quali si analizzano gli effetti positivi e negativi dell’uso terapeutico del principio attivo – e la sua non tossicità anche in situazioni di malattia del paziente[48]. Anche in questa fase una quantità imponente di farmaci fallisce la prova e viene abbandonata.
Fase 3 – si entra nel vivo della possibile nuova terapia. Il farmaco viene usato insieme ad altri già sviluppati per le stesse patologie, indagando statisticamente sul rapporto tra rischio e beneficio. Aumenta il numero dei pazienti interessati, che possono essere diverse migliaia di persone. Durante questa fase, che può durare fino a cinque anni, si controlla l’eventuale insorgenza, frequenza e gravità di effetti collaterali indesiderati. Solo se il farmaco dimostra efficacia e grandissima tollerabilità le agenzie (come la FDA negli Stati Uniti o la EMA nell’Unione Europea) ne approvano la diffusione e la commercializzazione[49]. Ma gli esami non sono ancora finiti.
Fase 4 – questa fase è detta “sorveglianza post marketing” perché viene attuata dopo l’immissione in commercio. Può durare qualche anno ed è utile per verificare più precisamente eventuali insorgenze di effetti indesiderati rari che non si erano verificati nelle precedenti fasi della sperimentazione[50]. Accade quindi, con una certa frequenza, che durante la Fase 4 le autorità di controllo, di fronte ad eventi gravi, decidano di ritirare il farmaco dal commercio e di proibirne la somministrazione.
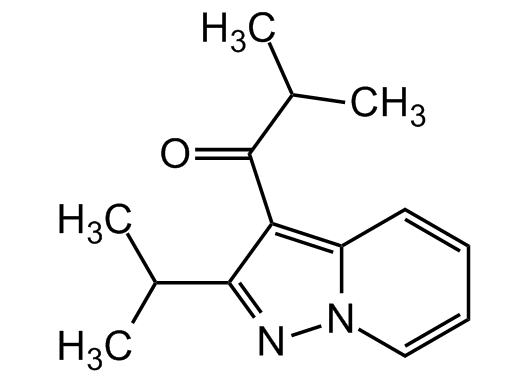
MediciNova ed il MN-166 (Ibudilast)
Sono cose che sappiamo da tempo. La scoperta del prodotto come inibitore della fosfodiesterasi risale addirittura al 1972, ed è opera di due medici statunitensi, Petko Uzunov e Benjamin Weiss[54]. Nel 1989 il brevetto dell’Ibudilast è stato comprato dalla Kyorin Pharmaceutical Company Ltd.[55], ed ha ottenuto già allora la licenza per il trattamento dell’asma[56]. Siccome, tra gli effetti collaterali del farmaco, ci sono una proprietà di rilassamento dei vasi sanguigni e di dilatazione bronchiale, dopo l’asma il farmaco è stato usato contro le vertigini post-ictus[57]. L’idea di analizzare l’uso dell’Ibudilast contro la sclerosi multipla è venuta nell’ottobre del 2004 ai medici giapponesi di un piccolo laboratorio, chiamato MediciNova Inc., cui Kyorin ha venduto una licenza esclusiva per lo sviluppo e la commercializzazione della molecola in tutto il mondo (esclusi Giappone, Cina, Corea del Sud e Taiwan)[58].
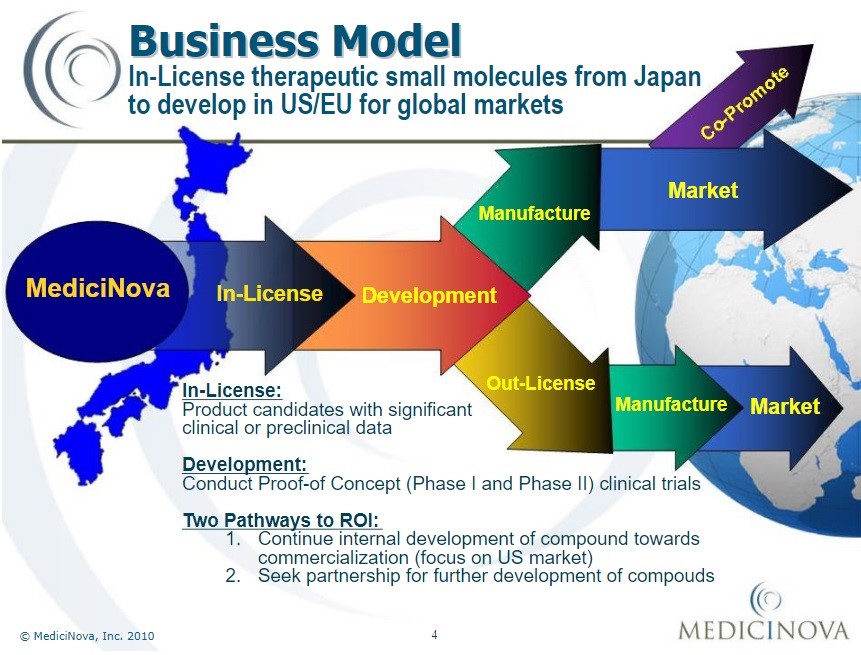
MediciNova, un team di scienziati giapponesi che lavora da La Jolla, in California, e da Tokyo[59], nasce nel settembre del 2000 come una costola del gruppo farmaceutico Tanabe Seiyaku Company Ltd. Osaka (oggi Mitsubishi Tanabe Pharma Corporation[60]) ed è oggi quotata sia alla borsa americana che a quella giapponese. Il promotore del progetto è il dottor Yuichi Iwaki[61], che si è specializzato nell’analizzare le possibilità di farmaci che, a suo parere, avrebbero delle possibilità di sviluppo che finora è stato sottovalutato dai giganti della farmaceutica, e poi allearsi con piccoli team, molto specializzati, fioriti in Giappone in questo secolo, per costruire nicchie di mercato nel gigantesco oceano del mercato statunitense[62].
In gergo tecnico, MediciNova (MN) si specializza nel riprofilare i farmaci, ovvero nel ricollocare un farmaco già esistente in un nuovo piano terapeutico attraverso nuovi studi[63]. MN lavora su diversi progetti: MN-001 (Tipelukast), contro la steatoepatite non alcolica e la fibrosi polmonare[64]; MN-221 (Bedoradrina)[65], MN-029 (Denibulina)[66], ma soprattutto MN-166 (Ibudilast) contro i disturbi neurologici come la sclerosi multipla progressiva (SM), la sclerosi laterale amiotrofica (SLA), la mielopatia cervicale degenerativa (DCM), la tossicodipendenza (alcoolismo compreso), ed ultimamente viene studiato il suo impiego nel trattamento dei sintomi del Covid-19[67].
L’intuizione sembra subito essere giusta. Già alla fine del 1990 la ricerca sugli animali rivela la capacità di ibudilast nel contrastare l’accumulo di calcio nel sistema nervoso centrale e nell’aorta addominale – impedisce la fosfodiesterasi, quindi le cellule sane non si ammalano[68]. Nel 1991 mostra la sua efficacia nelle cefalee, perché è anche vaso-rilassatore[69]. Nel 1993 si conferma la sua azione benefica nei casi di ictus ischemico[70]. Due anni dopo si osserva l’efficacia di ibudilast nel trattamento dei problemi di circolazione sanguigna degli arti inferiori di pazienti diabetici[71].
Nel 1997 una ricerca conferma la sua azione antinfiammatoria, perché attenua l’infezione delle cellule gliali[75]. La scoperta suggerisce ai ricercatori di verificare la sua utilità terapeutica in altre malattie respiratorie e, finalmente, nelle malattie neurologiche come la SLA o gli effetti della tossicodipendenza[76]. Giungono ulteriori conferme: nel 1999 il farmaco funziona su una malattia dei ratti, l’encefalomielite autoimmune sperimentale, sicché si candida a pieno titolo per il trattamento clinico dei pazienti affetti da SLA[77]. Nel 2004 si svolge la fase pre-clinica, ed i risultati sono molto più che incoraggianti[78]. Ma Kyorin vuole poterlo commercializzare il prima possibile, e nel 2007 punta (con successo) sul trattamento del dolore neuropatico: la farmacoterapia generalmente si basa sull’uso di analgesici oppioidi che hanno però un’efficacia modesta e di contro numerosi effetti collaterali, come sindromi da dipendenza e astinenza. Ibudilast, utilizzato in combinazione con gli oppioidi, sembra avere una duplice azione: quella di amplificare l’effetto analgesico e inibire in modo significativo la sindrome da dipendenza[79].
A questo punto entra in campo MediciNova, anche se con risultati non troppo soddisfacenti – uno studio effettuato nel 2010 su 297 pazienti affetti da sclerosi multipla, dopo 12 mesi, si chiude con una sconfitta: “Ibudilast non ha mostrato alcun effetto benefico sul tasso di nuove lesioni attive e recidive. Tuttavia, l’evidenza preliminare suggerisce che ibudilast sembra agire in modo neuroprotettivo (…) con un possibile effetto clinico benefico sulla progressione della disabilità”[80]. MediciNova non abbandona la partita, e sperimenta MN-166 (il nome dell’Ibudilast nel catalogo del laboratorio di Yuichi Iwaki) in coppia con altri trattamenti: non si vuole curare la SLA, ma solo rallentarne il progredire dei sintomi. Su questa base, nel 2012 la FDA (Food and Drug Administration) approva l’inizio della Fase 2 della sperimentazione clinica (IBU-ALS-1201), il cui obiettivo primario è valutare la sicurezza e la tollerabilità di MN-166 nel trattamento della sclerosi laterale amiotrofica su soggetti umani[81].
Nello stesso anno viene firmato un accordo di sviluppo congiunto tra MediciNova e l’Università del Colorado per il trattamento della lesione cerebrale post-traumatica[82]. Nel 2013 la MediciNova si attiva per una Fase 2b (NCT01982942), il cui scopo è di verificare sicurezza, tollerabilità e attività di ibudilast anche in soggetti con sclerosi multipla progressiva[83]. Lo studio viene fatto in collaborazione con il National Institutes of Health (NIH)[84], l’Istituto nazionale di disturbi neurologici e ictus (NINDS)[85] e con la National Multiple Sclerosis Society[86]. L’America della farmaceutica comincia a credere nel progetto.
Dopodiché i risultati positivi arrivano con la lentezza tipica di un procedimento legato ad una malattia così terribile. Nel 2015 una ricerca afferma che i topi resi dipendenti dall’alcool, se trattati con ibudilast, riducono la loro dipendenza del 50%[87]. Un team di un’altra azienda, dopo un’attenta analisi pre-clinica, afferma che, malgrado non sia stata riscontrata una diminuzione dell’infiammazione nella sclerosi multipla, si vede bene che l’Ibudilast ha un effetto positivo sulla conservazione del volume cerebrale e, quindi, frena la progressione della disabilità[88]. Nell’ottobre del 2016 la FDA concede altri sette anni di esclusiva a MediciNova per poter portare avanti gli studi e le sperimentazioni su questo progetto[89].

Nel marzo del 2018 Iwaki decide di abbandonare gli esperimenti del trattamento delle tossicodipendenze – i risultati sono troppo scarsi[90]. La FDA lo incoraggia, sostenendo che i risultati dicono che MN-166 “riduce il desiderio (e, quindi la dipendenza) e migliora il funzionamento cognitivo”[91], offrendo a MediciNova di continuare con la Fase 2. Nell’agosto del 2018 MediciNova annuncia l’avvio di uno studio di Fase 2 di MN-166 nella mielopatia cervicale degenerativa in collaborazione con l’Università di Cambridge e il Cambridge University Hospitals NHS Foundation Trust[92]. Lo studio si incentra sulla capacità della molecola di favorire la crescita nervosa nelle lesioni traumatiche del midollo spinale. Lo studio si conclude con un trionfo il 19 marzo del 2020[93]. I risultati dello studio di Fase 2 sono davvero molto incoraggianti[94]: il trattamento con MN-166 ha un effetto sul rallentamento della progressione della malattia e, per giunta, esercita un effetto protettivo, riducendo significativamente il rischio di nuove lesioni infiammatorie[95].
Questi risultati convincono la FDA che il farmaco abbia veramente un futuro, ed arriva quindi il benestare per la Fase 3[96], nonostante il piccolo laboratorio non abbia le infrastrutture previste dalla legge, che richiedono la necessità di poter verificare nei fatti i risultati di ogni somministrazione, di ogni terapia, di ogni paziente – ciò che in farmaceutica viene chiamato “endpoint” e che stabilisce l’adeguatezza di un trattamento[97]. Ma gli USA considerano la sclerosi talmente grave da aver deciso, nel 2015, di allargare le maglie nei casi di prodotti particolarmente promettenti per malattie dette “orfane”, perché risultano ancora incurabili[98]. Per ottenere la Fase 3, MediciNova deve dimostrare di avere un numero importante di pazienti disposti a rischiare e, con la sclerosi, non si fa fatica a trovarli[99]. Sicché l’avvio dello studio clinico di Fase 3 inizia nell’estate del 2020[100].
Ad agosto l’American Psychological Association, che ha compiuto un controesame su MN-166, conferma che l’Ibudilast riduce in modo significativo il desiderio quotidiano degli alcoolizzati[101]. Pochi mesi dopo, a dicembre, la FDA ammette l’uso di MN-166 in combinazione con un altro farmaco, l’interferone beta, per il trattamento della sclerosi multipla progressiva[102]. Nel gennaio 2021 MediciNova ottiene dalle autorità giapponesi la licenza di uso di MN-166 in combinazione con il Riluzolo (un farmaco che impedisce l’azione negativa del glutammato[103]) per il trattamento della sclerosi laterale amiotrofica (SLA)[104].
Pochi giorni fa MediciNova ha firmato un contratto con BARDA (Biomedical Advanced Research and Development Authority[105]) per la sperimentazione di MN-166 come contromisura contro i danni polmonari indotti dal cloro gassoso – come la sindrome da distress respiratorio acuto (ARDS) e il danno polmonare acuto (ALI)[106]. Sembrerebbe che siamo ad un passo dall’ottenimento della licenza, ad un passo dal poter dire alle migliaia di nuovi pazienti di sclerosi che esiste una vera speranza. Ma la corsa è ancora lunga, in salita, e piena di difficoltà.
Quell’infinita corsa ad ostacoli
La ricerca e lo sviluppo di un farmaco hanno costi imponenti. Secondo uno studio pubblicato su Jama Network nel marzo del 2020[108], sviluppare una nuova medicina costa in media 985 milioni di dollari: si va da un minimo di 314 milioni di dollari ad un massimo di 2,8 miliardi di dollari [109]. Una casa farmaceutica può impiegare fino a 15 anni prima di vedere il proprio prodotto in vendita e – se ci si interrompe a metà strada perché sono finiti i soldi, in mano non resta più nulla.
La concorrenza è un rischio determinante. Spesso ci sono diverse industrie che lavorano, tutte contemporaneamente, allo steso farmaco – ed una sola vince. C’è quindi il rischio di aver investito milioni di dollari per anni su un trattamento e venire sorpassati nell’ultimo miglio da un farmaco più efficace elaborato da un concorrente, meglio tollerato e per giunta magari meno costoso. La gara è ancora più difficile per piccole aziende che sono agli inizi e non hanno ancora un farmaco di successo sul mercato: MediciNova, nel solo 2020 ha registrato una perdita netta di 13,9 milioni di dollari. Se si calcolano i costi da quando è iniziata la sperimentazione di MN-166, siamo già a 382,9 milioni di dollari. Finché MN-166 o uno degli altri nuovi farmaci non andrà in produzione, le cose peggioreranno[110].
La verità è che MediciNova sta annegando nei debiti. Ha ridotto il numero dei dipendenti da 25 (2009) ad 8 (2019)[111], e l’unica speranza è avviare alleanze strategiche con grandi industrie farmaceutiche che credano nel futuro di MN-166 e di MN-001[112], ma su questo punto il team del Dottor Iwaki si è sbagliato di grosso. Nella nostra ricerca abbiamo contattato tre industrie multinazionali, la risposta è sempre stata la stessa: perché scendere a patti e pagare 100 ciò che, presumibilmente, dopo il fallimento di MediciNova pagheremmo 10? La società, affamata di capitali, decide di orientare la propria strategia allo sviluppo di un vaccino contro il Covid-19 e, nel luglio del 2020, annuncia l’avvio dello sviluppo di un nuovo farmaco insieme a BioComo Inc. Tsu[113] ed al partner istituzionale di Biocomo la Mie University di Tsu[114].
Ma questo farmaco non funziona. Nel marzo del 2021 MediciNova annulla il progetto[115] e lo sostituisce con una partnership, avviata con BARDA (Biomedical Advanced Research and Development Authority), che si impegna a sostenere finanziariamente e tecnologicamente lo sviluppo di MN-166[116]. L’annuncio fa impennare il valore delle azioni di MediciNova Inc., che raddoppia[117]. Quei soldi raccolti in borsa sono come la manna dal cielo. Nel frattempo MediciNova ha sul mercato il MN-221 contro l’asma e la versione di MN-166, combinata con il Riluzolo per il trattamento della sclerosi laterale amiotrofica (SLA), che prossimamente dovrebbe poter ottenere una licenza definitiva[118].
È una lotta contro il tempo, poiché la concessione del brevetto scadrà nel novembre 2035[119] e, visto che Ibudilast è un brevetto del 1989, a partire dal 2039 diverrà comunque un brevetto gratuito, come quello dell’aspirina, e chiunque potrà venderlo, non importa quanti soldi MediciNova abbia investito per svilupparlo. Negli Stati Uniti, intanto, in molte cliniche universitarie MN-166 viene somministrato ai pazienti che firmano per assumersene la responsabilità. La sclerosi multipla è una malattia che distrugge l’essere umano che colpisce, e lo fa in modo lento, feroce ed incontrovertibile. Quando si crede che la farmaceutica sia il Paese dei Balocchi, nel quale tutti riescano a guadagnare cifre esorbitanti senza avere dei costi che possano giustificare i prezzi di listino, bisogna ricordarsi di questa storia. E pregare, perché se l’Ibudilast funziona davvero, come sembra, ogni giorno perduto sono vite umane che se ne vanno.
[1] https://www.who.int/news-room/fact-sheets/detail/dementia#:~:text=Worldwide%2C%20around%2050%20million%20people,60%E2%80%9370%25%20of%20cases.
[2] https://comitatoparkinson.it/i-numeri-del-parkinson-in-italia/#:~:text=%E2%80%9CMEDICINA%3A%20Parkinson%2C%20400%20mila,%C3%A8%20legata%20all’et%C3%A0%20avanzata.
[3] https://journals.sagepub.com/doi/full/10.1177/1352458520970841#:~:text=A%20total%20of%202.8%20million,gaps%20in%20prevalence%20estimates%20persist.
[4] https://www.karger.com/Article/Fulltext/493386
[5] https://www.sciencedirect.com/science/article/pii/B9780123750006000847
[6] https://www.sciencedirect.com/science/article/pii/B9780750614474500074
[7] https://www.sciencedirect.com/science/article/pii/B9780123750006000847
[8] https://www.sciencedirect.com/science/article/pii/B9780750614474500074
[9] https://microspedia.blogspot.com/2020/11/real-electron-microscope-nerve-cell.html
[10] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[11] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[12] https://michaeldmann.net/mann_i.html#:~:text=A%20neuron%20is%20a%20cell,of%20the%20cell%20to%20another.
[13] Gilles Clément, Angie Buckey, William Paloski, “Artificial Gravity – History of artificial gravity”, Springer Science & Business, Berlin 2007, pages 62-65; https://www.ncbi.nlm.nih.gov/books/NBK21535/
[14] https://www.newworldencyclopedia.org/entry/Soma_(biology)
[15] https://www.newworldencyclopedia.org/entry/Dendrite
[16] https://itechmedicaldivision.com/elettrostimolazione-e-contrazione-volontaria/
[17] https://www.newworldencyclopedia.org/entry/Axon
[18] https://www.syfy.com/syfywire/go-beyond-the-infinite-with-2001-a-space-odysseys-discovery
[19] https://www.newworldencyclopedia.org/entry/Axon
[20] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[21] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[22] https://web.archive.org/web/20111107033302/http://www.storiain.net/arret/num50/artic6.htm ; www.monci.it/homogubernator/Elettromagnetismo/2E_Pile_Zamboni.htm
[23] https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
[24] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1860500/
[25] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1860500/
[26] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4191298/
[27] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4191298/
[28] https://alienanthology.fandom.com/wiki/The_Beast_Within:_The_Making_of_Alien
[29] https://www.rchsd.org/health-articles/lou-gehrigs-disease-als/
[30] https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Motor-Neuron-Diseases-Fact-Sheet
[31] https://www.policlinicocampusbiomedico.it/malattie/sclerosi-laterale-primaria#:~:text=La%20sclerosi%20laterale%20primaria%20%C3%A8,andamento%20dei%20sintomi%20%C3%A8%20progressivo.
[32] https://pubmed.ncbi.nlm.nih.gov/26515620/
[33] https://studiodiagnosticopantheon.it/latrofia-muscolare-progressiva-la-malattia-di-stephen-hawking/
[34] https://www.ninds.nih.gov/disorders/patient-caregiver-education/fact-sheets/amyotrophic-lateral-sclerosis-als-fact-sheet
[35] https://www.rxlist.com/fasciculation/definition.htm
[36] https://medlineplus.gov/ency/article/003188.htm
[37] https://www.aisla.it/vivere-con-la-sla/ipotesi-sulle-cause-della-sla/
[38] https://link.springer.com/article/10.1007/s00401-009-0545-9
[39] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4241182/
[40] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5536153/
[41] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2842587/
[42] https://pubmed.ncbi.nlm.nih.gov/21706151/
[43] https://pubmed.ncbi.nlm.nih.gov/17204932/
[44] https://toolbox.eupati.eu/resources/realizzare-un-farmaco-fase-6-fase-i-prova-del-meccanismo/?lang=it
[45] https://www.aifa.gov.it/sperimentazione-clinica-dei-farmaci
[46] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[47] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[48] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[49] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[50] https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are-different-types-clinical-research
[51] http://www.arisla.org/?p=8686
[52] https://www.openaccessjournals.com/articles/ibudilast-for-the-treatment-of-drug-addiction-and-other-neurological-conditions.pdf
[53] https://www.openaccessjournals.com/articles/ibudilast-for-the-treatment-of-drug-addiction-and-other-neurological-conditions.pdf
[54] https://chemport.cas.org/cgi-bin/sdcgi?APP=ftslink&action=reflink&origin=npg&version=1.0&coi=1%3ACAS%3A528%3ADyaE38XlsVyqtLw%3D&md5=93f10eb1f2cc78a01c54153040f0fdf4 ; https://www.sciencedirect.com/science/article/abs/pii/0005274472900605?via%3Dihub
[55] https://www.kyorin-pharm.co.jp/en/
[56] https://pubmed.ncbi.nlm.nih.gov/2556092/
[57] https://pubchem.ncbi.nlm.nih.gov/compound/3671
[58] https://materials.proxyvote.com/default.aspx?docHostID=322881
[59] https://medicinova.com/
[60] https://www.mt-pharma.co.jp/e/
[61] https://www.crunchbase.com/person/yuichi-iwaki
[62] https://plus.credit-suisse.com/rpc4/ravDocView?docid=V6A35B2AK-e
[63] https://www.nature.com/articles/nrd.2018.168 ; https://plus.credit-suisse.com/rpc4/ravDocView?docid=V6A35B2AK-e
[64] https://medicinova.com/clinical-development/core/mn-001-nash/
[65] https://medicinova.com/clinical-development/core/mn-221/
[66] https://medicinova.com/clinical-development/non-core/mn-029/medicinova-approach/ ; https://www.sec.gov/Archives/edgar/data/1226616/000156459019002835/mnov-10k_20181231.htm
[67] https://medicinova.com/clinical-development/core/mn-166/ ; https://www.scienceboard.net/index.aspx?sec=sup&sub=Drug&pag=dis&ItemID=1749
[68] https://pubmed.ncbi.nlm.nih.gov/2257963/
[69] https://headachejournal.onlinelibrary.wiley.com/doi/abs/10.1111/j.1526-4610.1991.hed3107483_1.x?sid=nlm%3Apubmed
[70] https://www.tandfonline.com/doi/abs/10.1080/01616412.1993.11740130
[71] https://journals.sagepub.com/doi/10.1177/000331979504600808
[72] Slide Presentation (sec.gov)
[73] https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1440-1681.1996.tb02772.x
[74] https://lamenteemeravigliosa.it/il-glutammato-neurotrasmettitore-multifunzione/
[75] https://pubmed.ncbi.nlm.nih.gov/9396033/
[76] http://rsds.org/wp-content/uploads/2015/02/Rolan_Ibudilast_Review.pdf
[77] https://www.jni-journal.com/article/S0165-5728(98)00251-3/fulltext
[78] https://journals.sagepub.com/doi/10.1191/1352458504ms1070oa ; https://www.sciencedirect.com/science/article/abs/pii/S0028390803003721?via%3Dihub
[79] https://www.tandfonline.com/doi/abs/10.1517/13543784.16.7.935?journalCode=ieid20 ; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2662518/
[80] https://n.neurology.org/content/74/13/1033
[81] https://clinicaltrials.gov/ct2/show/record/NCT02238626
[82] https://connections.cu.edu/stories/cu-boulder-medicinova-collaborate-brain-injury-therapy
[83] https://clinicaltrials.gov/ct2/show/study/NCT01982942
[84] https://www.ninds.nih.gov/
[85] https://www.ninds.nih.gov/
[86] https://www.nationalmssociety.org/
[87] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4017009/
[88] https://www.tandfonline.com/doi/abs/10.1080/13543784.2016.1221924?journalCode=ieid20
[89] https://alsnewstoday.com/news-posts/2016/10/18/ibudilast-mn-166-named-orphan-drug-for-amyotrophic-lateral-sclerosis-by-fda/
[90] https://www.globenewswire.com/news-release/2018/03/29/1455342/0/en/MediciNova-Announces-Results-of-Phase-2-Clinical-Trial-of-MN-166-ibudilast-in-Methamphetamine-Dependence.html
[91] https://www.researchgate.net/publication/297599603_Ibudilast_attenuates_subjective_effects_of_methamphetamine_in_a_placebo-controlled_inpatient_study
[92] https://www.globenewswire.com/news-release/2018/08/06/1547763/0/en/MediciNova-Announces-Initiation-of-NIHR-Grant-Funded-Phase-2-3-Trial-of-MN-166-ibudilast-for-the-Treatment-of-Degenerative-Cervical-Myelopathy-in-Collaboration-with-the-University-.html
[93] https://www.clinicaltrialsregister.eu/ctr-search/trial/2017-004856-41/GB#A
[94] https://www.nejm.org/doi/full/10.1056/NEJMoa1803583?query=featured_home
[95] https://www.globenewswire.com/news-release/2008/09/18/385032/150688/en/Data-From-MediciNova-s-Two-Year-Phase-II-Clinical-Trial-of-MN-166-in-Multiple-Sclerosis-Presented-At-the-World-Congress-for-Treatment-and-Research-in-MS-WCTRIMS.html ; https://www.nejm.org/doi/full/10.1056/NEJMoa1803583?query=featured_home
[96] http://www.globenewswire.com/news-release/2018/09/25/1576125/0/en/MediciNova-Announces-Positive-FDA-Feedback-Regarding-Phase-3-Plan-for-MN-166-ibudilast-in-ALS.html
[97] https://www.sec.gov/Archives/edgar/data/1226616/000156459019002835/mnov-10k_20181231.htm
[98] https://www.fdanews.com/articles/172717-fda-indicates-flexibility-in-drug-development-for-rare-diseases?utm_source=Real%20Magnet&utm_medium=Email&utm_campaign=80249611
[99] https://www.regulations.gov/document/FDA-2015-D-2818-0002 “Rare Diseases: Common Issues in Drug Development Guidance for Industry” U.S. Department of Health and Human Services – Food and Drug Administration – Center for Drug Evaluation and Research (CDER) – Center for Biologics Evaluation and Research (CBER) – August 2015
[100] http://www.arisla.org/?p=8686
[101] https://www.biospace.com/article/releases/medicinova-announces-the-presentation-of-positive-results-from-phase-2-trial-of-mn-166-ibudilast-in-alcohol-use-disorder-at-the-american-psychological-association-2020-annual-convention/
[102] https://www.globenewswire.com/news-release/2020/12/29/2151193/0/en/MediciNova-Receives-Notice-of-Allowance-for-New-Patent-Covering-MN-166-ibudilast-for-the-Treatment-of-Progressive-MS.html
[103] https://medisoc.it/scheda-riluzolo/
[104] https://seekingalpha.com/pr/18155450-medicinova-receives-notice-of-allowance-for-new-patent-covering-combination-of-mnminus-166
[105] https://www.phe.gov/about/barda/Pages/default.aspx
[106] https://www.globenewswire.com/news-release/2021/03/09/2189908/0/en/MediciNova-Announces-Partnership-with-BARDA-to-Develop-MN-166-ibudilast-as-a-Medical-Countermeasure-Against-Chlorine-Gas-induced-Lung-Injury.html
[107] https://news.ohsu.edu/2018/09/05/study-suggests-potential-of-new-therapy-for-progressive-multiple-sclerosis
[108] Autore Olivier J. Wouters, PhD, Department of Health Policy, London School of Economics and Political Science, Houghton Street, London WC2A 2AE, United Kingdom.
[109] https://jamanetwork.com/journals/jama/article-abstract/2762311
[110] https://sec.report/Document/0001564590-21-006771/#ITEM_7_MANAGEMENTS_DISCUSSION_ANALYSIS_1 pag. 55
[111] https://www.macrotrends.net/stocks/charts/MNOV/medicinova/number-of-employees
[112] https://sec.report/Document/0001564590-21-006771/#ITEM_7_MANAGEMENTS_DISCUSSION_ANALYSIS_1 pag. 55
[113] http://biocomo.jp/english.html
[114] https://www.globenewswire.com/news-release/2020/07/27/2067757/0/en/MediciNova-Announces-SARS-CoV-2-Vaccine-Joint-Development-with-BioComo-and-Mie-University-Japan.html
[115] https://www.theglobeandmail.com/investing/markets/stocks/MNOV-Q/pressreleases/1242556/
[116] https://drive.hhs.gov/ReDIRECT.html
[117] https://www.nasdaq.com/articles/medicinova-partners-with-barda-to-develop-chlorine-gas-induced-lung-injury-treatment-stock
[118] https://seekingalpha.com/pr/18155450-medicinova-receives-notice-of-allowance-for-new-patent-covering-combination-of-mnminus-166
[119] https://alsnewstoday.com/news-posts/2019/01/23/medicinova-closer-to-us-patent-ibudilast-rilutek-combo-for-als-neurodegenerative-diseases/




Devi fare login per commentare
Accedi